1.1 热力学基础
在进入气体和液体共存体系前,我们需要先了解一些热力学,实际上在气体部分我们已经提及了热力学第二定律,而接下来,我们来了解包括熵、焓、自由能、活度、逸度等名词和基本方程,以备后续使用。
热力学是描述平衡态以及平衡态之间的过程,涉及的变量参数主要包括宏观参数T,P,V,S和能量参数U,G,A,H,目的是消除基本功热关系中不好测量的W和Q。这些参数的核心关系式,构成了热力学的基础,不需要觉得有多复杂,其实就是上面的几个参数的定义,再利用全微分和麦克斯韦变换颠来倒去的就可以了。
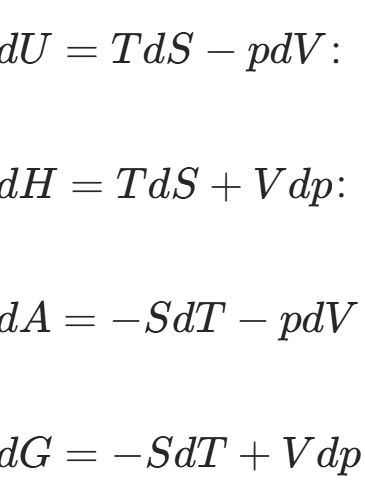
其中,我们主要先了解之前没怎么出现过,后面没怎么离开过的熵S,叫熵因为它就是个商。
熵S定义就是可逆过程的热温商,即热量变化和温度的商。通过两个状态下建立一组可逆过程,即可求得过程熵变ΔS,熵到底是什么我们后面再说。
焓H表示等压条件下系统吸收或放出的热量,这主要因为从事热力学研究的主要是生活在地球上的人类,他们无时无刻不受到地球大气的压力,因此在研究中,为了扣除大气压力的影响,简化计算,定义了焓H,从而在无需分别计算 “内能变化” 和 “压力体积功”,只需直接计算焓变即可得到热量变化。
![]()
而吉布斯自由能G,也是这个思路的一脉相承。其含义非常直白,由于任何过程TS都要大于可逆过程热量Q,而等压可逆过程热量变化刚才被定义为了焓H,所以所有过程的H-TS一定小于等于零,同时由于这个表达式是一个状态函数,干脆给个定义自由能G,自由能G可以用来判断过程的自发性。所谓自由能,类似我们平时说的可支配收入,就是说你可以随便花的能量,例如你挣到的钱(获得的能量),需要先干必须的,比如上交给老婆(克服地球压力做功PV)、定期汇贫困学生的资助费用(自身热变化TS),最后剩下的就是你可以随意支配的钱(吉布斯自由能),然后我们再知道一下ΔG与温度的关系——吉布斯-亥姆霍兹方程,保不齐后面那里会用到。
![]()
偏摩尔量与化学势 在多组分体系里,组分的物质量也是决定系统状态的变量。我们知道,一些容量性质是可以加和的,比如两个质量为m1和m2的物体混合到一起,质量是m1+m2,但除了质量之外,其他广度性质一般不等于两者之和。对于广度量A,我们定义:
为物质B的品摩尔广度量A。因此前面提到的广度性质需要额外增加物质量变化造成的广度性质变化,例如,吉布斯自由变化就需要额外修正为
![]()
G的偏微商就称为化学势。 显然,在气液两相混合物存在时,由于自发过程dG<0,如果一个组分在气相中的化学势比在液相中高,必然会向液相扩散,这也是为什么气体会向水中溶解的热力学解释。 对于单组分和多组分理想气体,而对于非理想气体,用逸度f代替压力即可
![]()
对于理想纯液体,通过平衡时气液相化学势相同,直接得到:
![]()
需要主要的是,理想液体混合焓变为零,混合体积变化为零,由于xB恒小于1,所以存在恒为正值的熵变,导致自由基小于零,理想液体混合都是熵驱动的自发过程。
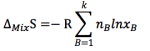
同时由于理想液体和理想蒸汽构成了平衡混合体系,两相B组分化学势相同:
![]()
移项后可以得到:
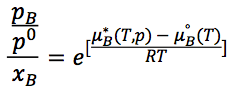
由于右侧在温度压力不变时为常数,设为kB,可以得到
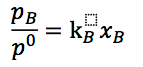
这就是关注微细气泡的我们非常熟悉的亨利定律表达式,当然,亨利定律本身是建立在实验数据基础上的经验定律。 当非理想溶液时,需要将组分数改为活度。
